14.1
Stručné základy obecné klinické enzymologie
Enzymy slouží v živých systémech jako biokatalyzátory, tj. urychlují většinu chemických dějů v nich probíhajících. Působí tak, že snižují aktivační energii reakce.
+
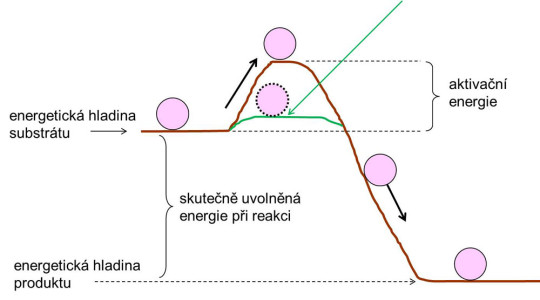
Enzymy snižují aktivační energii – analogie s kuličkou, padající z kopce a překonávající val
Svou povahou jsou to bílkoviny. Část molekuly, která je pro reakci zcela nezbytná, se nazývá aktivní centrum enzymu. Některé enzymy mají navíc nebílkovinnou součást (koenzym); jako koenzymy slouží obvykle deriváty vitaminů skupiny B.
Látka, jejíž přeměnu enzym katalyzuje, se nazývá substrát (S); je přeměňován na produkt (P). Enzym není pasivním účastníkem reakce, ale velice aktivně se na ní podílí. Vytváří se substrátem komplex, který je přeměněn na komplex enzym-produkt a po jeho rozštěpení se enzym uvolňuje v původní podobě, schopný katalyzovat přeměnu další molekuly substrátu.
Enzym přeměňuje jen „svůj substrát“; hovoří se o specifičnosti enzymové reakce. Ta je dvojího druhu:
- substrátová – enzym katalyzuje přeměnu jen jediného substrátu; tak např. glukózaoxidáza katalyzuje pouze oxidaci glukózy;
- funkční – enzym katalyzuje stejný typ reakce u příbuzných substrátů: fosfatáza štěpí různé estery kyseliny fosforečné, alkoholdehydrogenáza katalyzuje oxidaci nejen etanolu, ale i metanolu a etylenglykolu aj.
14.1.1
Názvosloví a vyjadřování aktivity enzymů
Názvy enzymů jsou v podstatě trojího typu:
- triviální (historické) – např. pepsin, trypsin;
- obecně užívané, ukazující obvykle substrát a často i typ jeho přeměny – např. laktátdehydrogenáza, kreatinkináza;
- vědecké, definující zcela přesně substrát i produkt, typ přeměny i event. potřebný koenzym. Byla vytvořena vědecká desetinná klasifikace; každý z enzymů je identifikován čtyřmístným číslem. Prvé z nich enzym zařazuje do jedné z šesti tříd, další čísla pak určují enzym stále přesněji podle typu reakce, koenzymu ap., až čtvrté, poslední číslo identifikuje substrát, a tedy určuje enzym definitivně. Přiklad: laktátdehydrogenáza se správně nazývá: L-laktát: NAD+ oxidoreduktáza, EC 1.1.1.27.
Množství enzymu se obvykle uvádí podle látkového množství substrátu, přeměněného na produkt za časovou jednotku. Hovoříme o enzymové aktivitě či správněji katalytické koncentraci enzymu. Jednotkou této veličiny v SI soustavě je katal (zkratka kat). Je to takové množství enzymu, které katalyzuje přeměnu 1 molu substrátu za 1 sekundu, a to za definovaných podmínek (teplota, pH, přítomnost aktivátorů, úplné nasycení molekul enzymu substrátem ap.). Protože se jedná o jednotku příliš velkou, užívají se jednotky menší, vztažené obvykle na 1 litr vyšetřované tekutiny (např. séra), obvykle µkat/l = 10–6 kat/l.
Dříve užívaná mezinárodní jednotka (U, event. IU) byla definována obdobně, ale vztahovala se na přeměnu 1 µmolu substrátu za 1 min. Platí proto následující vztah: 1 µkat/l = 60 U/l.
Imunochemické stanovení enzymů se používá tehdy, vyskytuje-li se příslušný enzym v biologickém materiálu ve velmi nízké koncentraci. Metoda je založena na reakci enzymu (antigenu) se specifickou protilátkou a nestanovuje se schopnost enzymu katalyzovat určitou reakci, ale molekula enzymu jakožto antigen. Stanovuje se tedy hmotnostní koncentrace („mass concentration“) enzymu a jednotkou jsou obvykle µg/l.
14.1.2
Faktory ovlivňující rychlost enzymové reakce
Rychlost enzymové reakce, tj. počet molekul substrátu přeměněných za časovou jednotku, je ovlivňována množstvím faktorů. K nejdůležitějším patří následující:
- teplota; jako u všech chemických reakcí s rostoucí teplotou vzrůstá rychlost pohybu molekul, a tedy i pravděpodobnost, že se setkají a budou spolu reagovat. U enzymových dějů však po dosažení optimální teploty (obvykle 37 °C) začne rychlost reakce opět klesat; je to způsobeno tepelnou denaturací bílkovinných molekul enzymu;
+
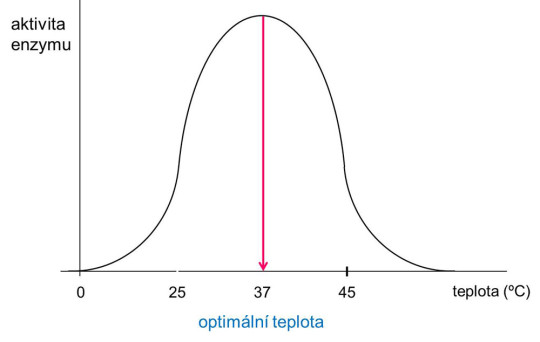
Závislost rychlosti enzymové reakce na teplotě
- acidita (pH); existuje optimální pH, při kterém enzymová reakce probíhá nejrychleji, se vzdalováním se od tohoto optima na obě strany rychlost přeměny klesá. Většina enzymů má pH-optimum mezi 7 – 8, existují však výjimky (pH optimum pepsinu je 1 – 2, alkalické fosfatázy 10);
- aktivátory; jsou to látky, umožňující či urychlující enzymovou reakci. Patří k nim ionty některých dvojmocných kovů, jako např. Ca2+, Mg2+, Zn2+ ap. Tak např. pro aktivitu všech kináz je nezbytná přítomnost Mg2+;
- inhibitory; jsou to látky, které zpomalují nebo zastavují enzymovou reakci. S určitou mírou zjednodušení rozlišujeme dva typy inhibitorů:
- koncentrace substrátu; je-li dostatečně vysoká, probíhá enzymová reakce podle kinetiky nultého řádu, tj. závislost rychlosti (přírůstku koncentrace produktu) na čase je lineární. Při nízké koncentraci substrátu se rychlost reakce snižuje spolu s klesající pravděpodobností, že při stále menší koncentraci substrátu se jeho molekula setká s enzymem. Závislost rychlosti na čase má tvar paraboly a hovoříme o kinetice prvého řádu.
14.1.3
Princip stanovení aktivity enzymů
Aktivitu enzymů obvykle stanovujeme spektrofotometricky: k séru se přidá substrát, který se působením enzymu mění na barevný produkt (výjimečně je přeměňován barevný substrát na bezbarvý produkt). Absorbanci je možné měřit po zastavení reakce po různě dlouhé inkubaci (metoda end-point) nebo je měřena absorbance opakovaně v průběhu reakce. Vybere se časový úsek, kdy je nárůst absorbance lineární, a podle strmosti jejího nárůstu se určí aktivita enzymu. Tento způsob, zvaný metoda kinetická, je správnější a je mu jednoznačně dávána přednost.
14.1.4
Dělení enzymů podle místa vzniku a účinku
Podle tohoto kritéria rozlišujeme enzymy:
- buněčné, které vykonávají svou funkci intracelulárně, tedy v místě svého vzniku. Při poškození buněk se z nich tyto enzymy uvolňují a dostávají se do krevního oběhu, kde lze zjistit jejich zvýšenou aktivitu. Patří sem většina enzymů užívaných v klinicko-biochemické diagnostice, mj. AST, ALT, CK, LD, GGT ap.;
- sekreční, které působí v místě odlišném od místa svého vzniku; dají se rozdělit na dvě podskupiny:
14.1.5
Izoenzymy a makroenzymy
Za izoenzymy považujeme molekuly enzymů, které katalyzují stejnou reakci, ale jejichž bílkovinná molekula se liší primární strukturou (pořadím aminokyselin), event. i cukernou složkou, a tedy i fyzikálně chemickými vlastnostmi. Nejznámější jsou izoenzymy ALP, CK a α-amylázy; budou popsány u jednotlivých enzymů.
Makroenzymy nejčastěji vznikají vazbou imunoglobulinu na molekulu enzymu. Od „normálních“ enzymů se liší nejen velikostí molekuly, ale i delším biologickým poločasem. Mohou se projevit dlouhodobě přetrvávající zvýšenou aktivitou enzymu v krevním séru a při neznalosti této problematiky bývá nález nesprávně interpretován. Někdy je najdeme u pacientů se současně probíhajícím autoimunitním onemocněním, jindy bez zjevné příčiny. Nejznámější je nález makroamylázy (viz dále).
14.1.6
Ochrana před proteolytickými enzymy
Zcela speciální je problematika aktivace proteolytických enzymů. Aby nedošlo ke štěpení proteinů v nevhodnou dobu a na nevhodném místě, jsou proteázy produkovány jako neaktivní proenzymy (zymogeny). V případě potřeby jsou aktivovány odštěpením části molekuly, jako např. proteolytické enzymy v trávicí trubici.
V plazmě je dále přítomna řada inhibitorů proteáz bílkovinné povahy, které mají za úkol inaktivovat proteázy uvolněné např. z leukocytů při zánětlivých pochodech. Přesto může dojít k nekontrolované aktivaci proteáz s těžkým poškozením tkání, např. při akutní pankreatitidě či syndromu diseminované intravaskulární koagulace (DIC).
14.1.7
Využití enzymů při stanovení substrátů
Je-li substrátem enzymu látka důležitá pro diagnostiku, může být enzym s výhodou užit ke stanovení její koncentrace v biologickém materiálu. Využívá se obvykle měření zabarvení produktu nebo se naváže další enzymová reakce, která teprve vede ke vzniku zabarvení.
Příkladem může být užití glukózaoxidázy nebo hexokinázy ke stanovení glukózy, ke stanovení močoviny se užívá ureáza, kyseliny močové urikáza, v případě cholesterolu pak cholesterolesteráza v kombinaci s dalšími enzymy, katalyzujícími navazující reakce ap. Poslední tzv. indikační reakcí je obvykle Trinderova reakce katalyzovaná peroxidázou nebo tzv. optický test, využívající přeměnu NAD(P)+ na NAD(P)H a naopak.
Výhodou těchto metod ve srovnání s dříve užívanými „čistě chemickými“ metodami bez enzymů je především vysoká specifičnost pro stanovovanou látku a fakt, že reakce obvykle probíhá při fyziologickém pH a teplotě 37 °C. Toto vše předurčuje enzymové metody k automatizaci.