2.1
Izolace a identifikace bakterií
Definice
Určení bakteriálního druhu je nezbytné, jak pro vědeckou práci, tak pro praxi, kdy se musí mikroflóra vzorku diferencovat, vyizolovat a přesně identifikovat. Přesné druhové určení je potřebné k rozlišení patogenních mikroorganismů, ke stanovení původců mikrobiálních technologických vad, při výzkumu, sestavování čistých kultur apod.
Individuální určování může navazovat na určení skupinové, kterým se přítomná mikroflóra přibližně diferencuje do skupin fyziologicky a biochemicky podobných mikroorganismů. Může také vycházet z kmenů izolovaných přímo ze vzorku nebo z kolonií narostlých při stanovení celkového počtu mikroorganismů.
Souhrn
V běžné diagnostické praxi je možno postup identifikace obecně rozdělit do čtyř fází.
- Izolace čisté kultury.
- Mikroskopické vyšetření.
- Kultivační vyšetření.
- Biochemická diagnostika.
2.1.1
Izolace čisté kultury
Definice
Základní podmínkou pro úspěšnou identifikaci mikroorganismu je izolace čisté kultury. Izolovaná kultura musí obsahovat buňky geneticky, fyziologicky a morfologicky stejnocenné, tj. buňky náležející k jednomu kmeni. Nejjednodušší způsob izolace je opakované frakcionované očkování.
Jako výchozí materiál se volí samostatná kolonie typických vlastností. Je-li kolonie drobná nebo v těsném sousedství jiných kolonií, je vhodné přenést ji hrotem očkovací jehly místo kličkou. Je třeba dát pozor, aby se při přenosu nedotkla očkovací klička nebo jehla sousedních kolonií nebo nesterilního okolí.
Jestliže je výchozí kolonie ponořena pod povrchem agaru, vyřízne se sterilním skalpelem bloček půdy tak, aby byl řez veden pokud možno mimo sousední kolonie. Přenese se do sterilní Petriho misky nebo na sterilní podložní sklo a sterilními preparačními jehlami nebo skalpely se rozdělí tak, aby se odkryla zkoumaná kolonie. Nachází-li se kolonie ve sloupci půdy ve zkumavce (například při izolaci laktobacilů nebo jiných anaerobů), je nutno sloupec půdy ze zkumavky asepticky vyklepnout do sterilní Petriho misky a kolonii vypreparovat podobně jako v předcházejícím případě.
Materiál odebraný z povrchových i ponořených kolonií se frakcionovaně očkuje na vhodnou půdu přímo, nebo se suspenduje ve fyziologickém roztoku a očkuje se vzniklá suspenze. Bývá výhodné používat různé selektivní půdy. Při izolaci přísných anaerobů je třeba dodržet anaerobní kultivační podmínky. Po inkubaci se na základě mikroskopické kontroly vybere vhodná kolonie pro opakované frakcionované očkování. Z této druhé, případně až třetí izolace se naočkuje po další mikroskopické kontrole typická kolonie na pomnožovací půdu, na které naroste dostatečné množství materiálu pro následující rozbory.
K izolaci mikrokolonií je vhodná sterilní skleněná trubička vytažená v kapiláru, kterou se vykrojí bloček půdy i s mikrokolonií a vyfoukne se do tekuté pomnožovací půdy. Odběr mikrokolonie se dělá pomocí lupy nebo preparačního mikroskopu.
Izolaci lze provést také ředěním dobře homogenizované výchozí suspenze z odebraného materiálu tak, aby po naočkování do agarové půdy v Petriho misce narostly jen jednotlivé kolonie. Vybraná typická kolonie se znovu jedenkrát až dvakrát stejným způsobem ředí a nakonec naočkuje do pomnožovací půdy.
+
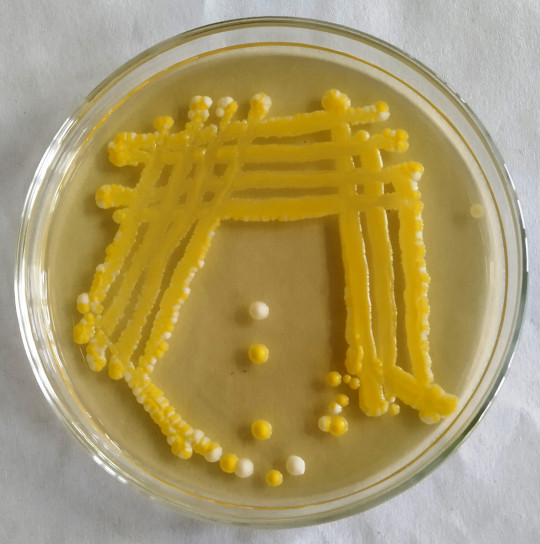
Obr. 10. Kontaminovaná kultura
2.1.2
Mikroskopické vyšetření
Klíčový význam má zjištění, zda je izolát grampozitivní nebo gramnegativní. Při barvení preparátu podle Grama se musí přesně dodržet pracovní postup a vzít v úvahu všechny faktory ovlivňující výsledek. Při neurčitých výsledcích je nutno připravit nový preparát nebo vyšetřit kulturu postupně v různém stáří. Z dalších druhů mikroskopického vyšetření používaných v diagnostice je možno připomenout barvení spor, bičíků, pouzder, stanovení pohyblivosti v nativním preparátu a zjišťování tvaru a velikosti buněk.
+
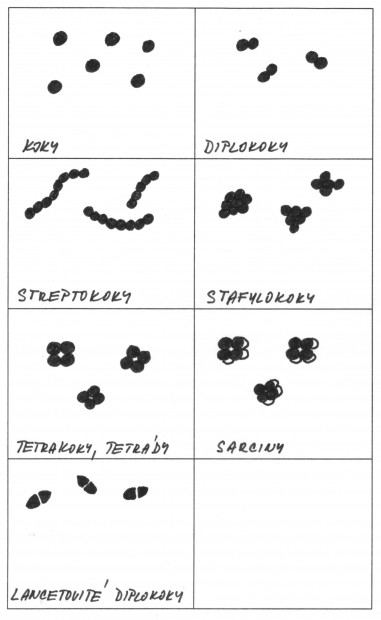
Obr. 11. Tvar a uspořádání bakteriálních buněk – koky
+

Obr. 12. Tvar a uspořádání bakteriálních buněk – tyčinky
+
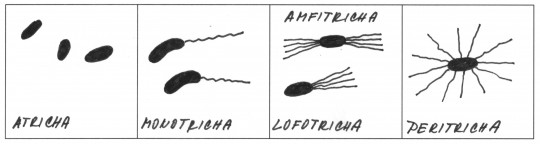
Obr. 13. Uspořádání bakteriálních bičíků
+
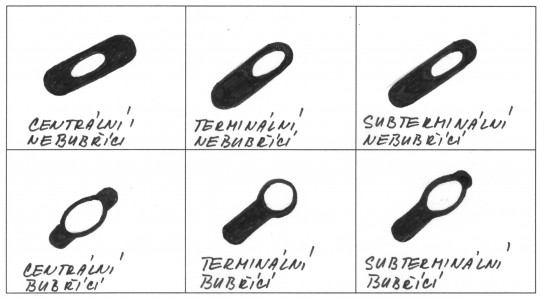
Obr. 14. Uspořádání bakteriálních spor
2.1.3
Kultivační vyšetření
Definice
Kultivačním vyšetřením se zjišťuje charakter růstu v tekutých a polotuhých půdách, typ kolonií a pigmentace. Pigmentace některých druhů bakterií je podmíněna složením živné půdy a k průkazu se musí používat speciální média. Někdy se též zjišťuje pohyblivost v půdách s nízkým obsahem agaru a teplotní rozmezí růstu nebo schopnost růstu při limitující teplotě.
2.1.3.1
Charakter růstu v tekutém médiu
Růst mikroorganismů v tekutém médiu se projevuje změnou vzhledu média. Je to především tvorba zákalu, sedimentu, blanky.
- vzhled povrchu – na povrchu tekutého média se může vytvořit povrchová blanka (podobná křísu), lehký šum, prstenec
- zákal – může být difuzní, vločkovitý nebo se tvoří sedlina
- sediment – může být zrnitý, hlenovitý, vločkovitý, jemný, hrubý, roztřepatelný, neroztřepatelný
- vůně či zápach – může být fekální, hnilobný, nasládlý, amoniakální, kvasničný, mléčný, typický pro daný mikroorganismus
+
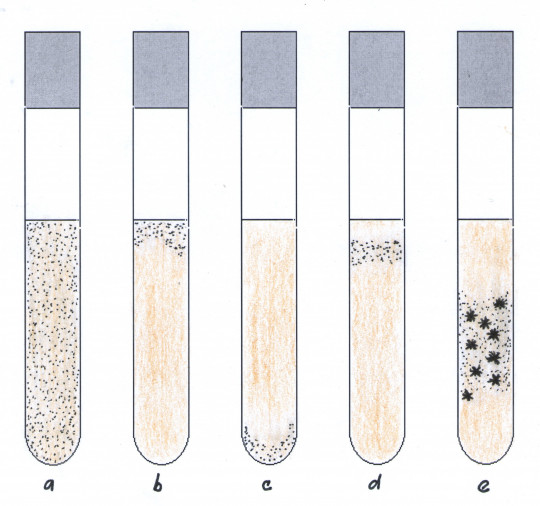
Obr. 15. Růst v tekuté živné půdě: a) zákal, b) růst ve svrchní vrstvě, c) sediment, d) růst pod svrchní vrstvou, e) tvorba hrubých vloček
2.1.3.2
Charakter růstu na tuhých půdách na Petriho miskách
Obecně platí, že vzhled kolonie je závislý na stáří kultury a kultivačních podmínkách. Mladší kolonie bývají drobnější, hladší s rovnějšími okraji, později se může objevit rýhování, zdrsnění, propadlý střed a různé nerovnosti. Složení živné půdy silně ovlivňuje vzhled kolonií, zejména u speciálních živných půd. Dochází zde k interakcím mezi kolonií a živnou půdou. Proto je nutné uvádět podmínky kultivace (teplota a doba kultivace) a použitou živnou půdu. Charakteristické kolonie vzniknou po inkubaci za optimální teploty a doby (bakterie 1 – 3 dny, kvasinky 3 dny, plísně 5 – 7 dnů).
Při posuzování bakteriálních kolonií narostlých na tuhých půdách na Petriho miskách si všímáme následujících znaků:
- velikost – kolonie mohou mít různou velikost, která se vyjadřuje průměrem v mm, mohou být od drobných až po tzv. obrovské, (drobné kolonie – méně než 1 mm, malé 1 mm, střední 2 – 3 mm, velké 5 mm a více)
- tvar – okrouhlý, laločnatý, kořenovitý, zvlněný, sektorový, vláknitý, nepravidelný
- povrch – hladký, hladký s papilami, lesklý, matný, drsný, zvrásněný, suchý, vlhký
- transparence – průhledná, průsvitná, neprůsvitná
- profil – plochý, vyvýšený, rovný, vyvýšený s vyvýšeným nebo propadlým středem, vypouklý, bradavičnatý, pupkovitý
- okraj – rovný, hladký, vroubkovaný, vlnitý, laločnatý, vláknitý, rhizoidní, vyvýšený
- konzistence – slizovitá, kašovitá, moučná, kožovitá, mazlavá, máslovitá, drobivá, vosková
- pigmentace – barva kolonií je daná tvorbou pigmentu (žlutá, oranžová, červená, hnědá) nebo chemickými složkami živného média
- interakce s živnou půdou – biochemické reakce v okolí kolonií např. precipitace, projasnění, hemolýza, zbarvení okolí kolonií
- vůně nebo zápach – nasládlý, fekální, amoniakální, kvasničný, česnekový, zemitý, nakyslý
- vztah k ostatním MO
+

Obr. 16. Tvar bakteriálních kolonií
+
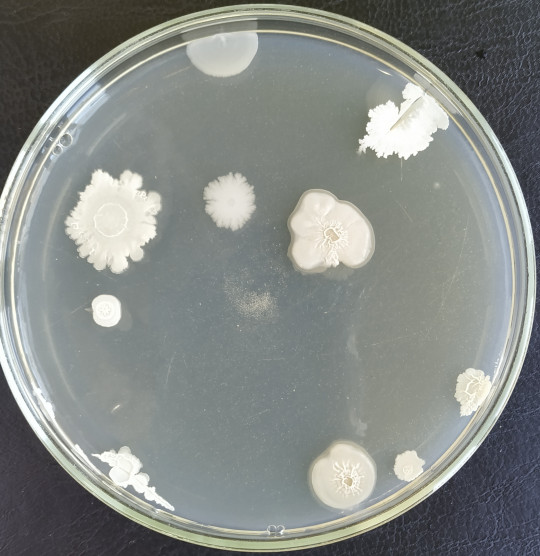
Obr. 17. Různé tvary kolonií vyrostlých na Petriho misce
+

Obr. 18. Okraj bakteriálních kolonií
+
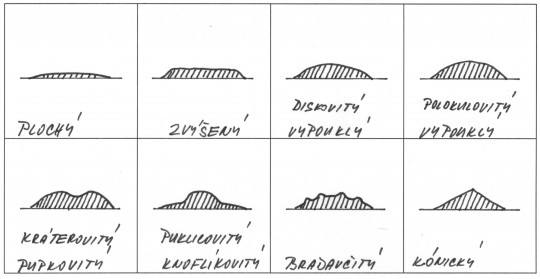
Obr. 19. Profil bakteriálních kolonií
2.1.3.3
Charakter růstu na šikmém agaru
Inokulace na správně připravený šikmý agar se provádí pomocí očkovací kličky rovným nátěrem, po optimální inkubaci hodnotíme růst.
- rychlost růstu – žádný růst, pomalý růst, středně rychlý růst, rychlý růst
- tvar nátěru – rovný, stromečkovitý, bodovitý, výběžkovitý, difúzní, kořínkovitý
- povrch nátěru – lesklý, matný, moučný
- konzistence – suchá, máslovitá, hlenovitá
- barva – bílá, smetanová, žlutá, oranžová, růžová, červená, podle pigmentu
+

Obr. 20. Charakter růstu na šikmém agaru: a) růst rovný, b) stromečkovitý, c) bodovitý, d) výběžkovitý, e) difúzní, f) rhizoidní
2.1.3.4
Charakter růstu podél vpichu do agarové půdy
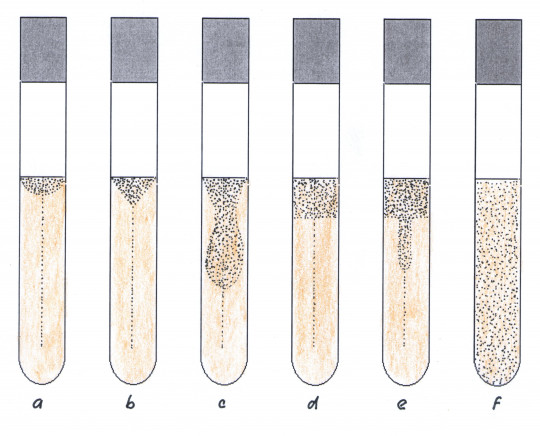
Do vysokého sloupce živné půdy se zaočkuje vpichem testovaná kultura, po optimální kultivaci se vyhodnocuje růst. Růst může být např. spojitý, kartáčovitý, bodový, kořínkovitý. Podle charakteru růstu podél vpichu lze usuzovat i na nároky mikroorganismů na kyslík.
- aerobní mikroorganismy – rostou v horní části vpichu
- mikroaerofilní mikroorganismy – rostou ve střední části vpichu
- fakultativně aerobní mikroorganismy – rostou podél celého vpichu
- anaerobní mikroorganismy – rostou ve spodní části vpichu
+

Obr. 21. Charakter růstu podél vpichu do agarové půdy: a) aerobní mikroorganismy, b) mikroaerofilní druhy, c) fakultativně anaerobní druhy, d) anaerobní druhy
2.1.3.5
Fyziologické vlastnosti bakterií
Pohyblivost, schopnost růstu při různých teplotách, vztah mikroorganismů ke O2, schopnost růstu v různých koncentracích NaCl, sacharidů nebo při různém pH. To jsou jedny ze základních fyziologických vlastností mikroorganismů.
Stanovení pohyblivosti mikroorganismů
Princip:
Test pohyblivosti ověřuje přítomnost bičíků. Mikroorganismy bez bičíků jsou nepohyblivé. Pohyblivost lze sledovat mikroskopicky pozorováním nativního preparátu nebo kultivačně za použití polotuhého média ve zkumavce. Pohyblivé mikroorganismy jsou schopny po zaočkování vpichem prorůstat z místa vpichu do okolí a vytvářet zákal. Mikroorganismy nepohyblivé rostou pouze v místě vpichu.
Postup:
Polotuhé živné médium MPA ve vysokém sloupci očkujeme čistou bakteriální kulturou vpichem. Vpich by měl končit asi 0,5 cm ode dna zkumavky. Zkumavky kultivujeme po dobu 24 – 72 hodin při 30 °C.
Hodnocení:
Pohyblivé kultury prorůstají z místa vpichu celou živnou půdou a vytváří zákal. Nepohyblivé mikroorganismy rostou pouze v místě vpichu.
+
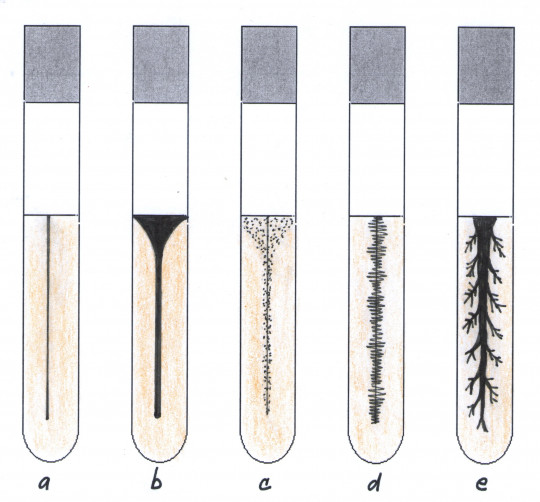
Obr. 22. Charakter růstu pohyblivých bakterií: a) nepohyblivý druh, b) deštníkovitý růst, c) deštníkovitý bodový růst, d) kartáčovitý růst, e) rhizoidní růst
2.1.4
Biochemická diagnostika
Mikroskopické a makroskopické morfologické znaky samy o sobě nestačí k dokonalému určení. Mnohem více informací poskytují vlastnosti vyplývající z rozdílné enzymové výbavy jednotlivých skupin mikroorganismů. Tyto rozdíly projevující se odlišnou látkovou výměnou je možno kvalitativně i kvantitativně zjišťovat podle změn substrátu a podle výsledných produktů. Používají se k tomu biochemické testy založené na stanovení přeměn uhlíkatých a dusíkatých substrátů, na průkazu typických enzymů a na důkazu specifických metabolitů.
2.1.4.1
Biochemické vlastnosti bakterií
Následují pouze vybrané testy běžně používané při identifikaci bakterií v potravinářství.
Schopnost zkvašovat různé druhy cukrů, průkaz glukosidáz
Princip:
Tekutá půda je obohacena o zkoušený cukr (např. glukózu, sacharózu, laktózu, maltózu, ribózu, trehalózu, nejčastěji se jedná o přídavek v množství 0,5 – 1 %) a indikátor pH (bromthymolová modř nebo fenolová červeň). Pokud testovaná kultura daný cukr zkvašuje, sníží se vlivem vzniklých kyselin pH a nastane změna zbarvení indikátoru z původní zelené, případně červené, na žlutou. Vzniká-li při kvašení také plyn, vytvoří se v plynovce bublina.
Postup:
Sterilní očkovací kličkou nabereme čistou kulturu testovaného mikroorganismu a suspendujeme ji do řádně označených zkumavek. Inkubujeme při optimální teplotě 30 °C 1 – 3 dny.
Hodnocení:
Po 24, 48 až 72 hodinách inkubace vyhodnotíme změnu barvy média, zákal, blanku nebo sediment a přítomnost bublinek plynu v plynovce. V pozitivním případě dochází ke zkvašování sacharidů a tím ke tvorbě organických kyselin, které způsobí změnu pH a změnu barvy indikátoru (půda zežloutne). Bublina v plynovce dokazuje tvorbu plynu.
+

Obr. 23. Vyhodnocení testu: zelená barva negativní reakce, zežloutnutí pozitivní reakce
Princip:
Slouží ke zjištění, zda je daný mikroorganismus schopný využívat glukózu kvašením (fermentací) za anaerobních podmínek nebo aerobní oxidací za přístupu kyslíku. Používá se polotuhá agarová půda s glukózou a bromthymolovou modří ve zkumavkách. Anaerobní podmínky vytvoříme převrstvením sterilním parafinovým olejem nebo parafin-vazelínovou zátkou.
Postup:
Testovanou kulturu očkujeme vpichem souběžně do dvou zkumavek. Jednu přelijeme vrstvou parafinového oleje nebo rozpuštěnou směsí parafínu a vazelíny. Inkubujeme v termostatu při 30 °C 3 dny.
Hodnocení:
Rozklad glukózy se projeví změnou barvy, v případě tvorby plynu vznikem plynových bublinek a trhlinek v půdě. Mikroorganismy oxidující glukózu aerobně způsobí okyselení půdy (původně zelené médium zežloutne) ve zkumavkách bez parafinového oleje. Žloutnutí postupuje od povrchu ke dnu zkumavky, ve zkumavce s parafinem k žádným změnám nedojde. Pokud mikroorganismy glukózu zkvašují (fermentují) za anaerobních podmínek, způsobí zežloutnutí půdy v celém objemu v obou zkumavkách. V případě, že mikroorganismy glukózu nerozkládají, nedochází ke změně v žádné ze zkumavek. Také může dojít k alkalizaci půdy, což se projeví zmodráním.
+

Obr. 24. Vyhodnocení testu: pozitivní fermentace glukózy
+

Obr. 25. Vyhodnocení testu: mikroorganismy glukózu nerozkládají
+

Obr. 26. Vyhodnocení testu: aerobní oxidace glukózy
Hydrolýza škrobu (důkaz amylas)
Princip:
Škrob je polysacharid, který je tvořen řetězcem glukózových zbytků. Amylolytické mikroorganismy vylučují enzymy amylasy, které rozrušují glykosidické vazby, tvoří se tak dextriny o stále kratším řetězci, až jako konečný produkt vzniká maltóza. Rozeznáváme α-amylasu (tzv. dextrinogenní), která štěpí škrob převážně jen na dextriny, a β-amylasu (sacharogenní), která štěpí škrob až na maltózu. Schopnost bakterií produkovat amylasy se zjišťuje na agarové půdě s 2 % škrobu. Produkty rozkladu škrobu se dokáží barvením roztokem jodu.
Postup:
Na Petriho misku vylijeme ŠA (škrobový agar) a necháme utuhnout. Sterilní očkovací kličkou odebereme inokulum a naočkujeme tenkou rovnou čarou doprostřed misky. Kultivujeme 3 dny při 30 °C. Po inkubaci navrstvíme na povrch živné půdy Lugolův roztok, necháme působit 15 – 30 sekund a pak jeho přebytek slijeme a vyhodnotíme.
Hodnocení:
Pozorujeme, zda na okraji kolonií (nátěru) vzniklo modré, červené, hnědé nebo žluté zabarvení. Modré zabarvení znamená, že škrob nebyl hydrolyzován (enzym amylasa není přítomen). Červené a hnědé zabarvení znamená, že škrob byl rozložen na dextriny (enzym α-amylasa je přítomen). Žluté zbarvení znamená, že škrob byl rozložen (hydrolyzován) až na cukr maltózu (enzym β-amylasa je přítomen).
+

Obr. 27. Vyhodnocení testu: pozitivní rozklad škrobu na dextriny, hnědá zóna kolem nátěru
Princip:
Zkouška s metylčervení umožňuje zjistit konečné pH, které záleží na množství kyselin vyprodukovaných z glukózy.
Postup:
Tekutá půda se po naočkování kličkou suspendováním inkubuje 2 – 5 dní při 30 °C. Po inkubaci se na 5 ml půdy přidá 5 až 6 kapek etanolového roztoku metylčerveně.
Hodnocení:
Při okyselení na pH 4,4 – 4,0 se zbarví půda červeně (pozitivní reakce), žluté zbarvení znamená menší okyselení (negativní reakce).
+

Obr. 28. Vyhodnocení testu: pozitivní reakce červené zbarvení, negativní reakce žluté zbarvení
Princip:
Test slouží k důkazu tvorby acetoinu (acetylmethylkarbinolu) z glukózy.
Postup:
Půda se naočkuje kličkou kultury a inkubuje při 30 °C 4 dny. Pak se k 1 ml půdy přidá 0,5 ml 40% roztoku KOH (VPT I) a promíchá se. Opatrně se převrství 0,5 ml Barritova činidla (5% etanolový roztok α-naftolu, VPT II).
Hodnocení:
Pozitivní reakce se projeví vznikem fialově červeného prstence na styčné ploše obou roztoků. Typická je pozitivní reakce např. pro rody Enterobacter, Klebsiella a Serratia. Negativní reakci mají ostatní zástupci čeledě Enterobacteriaceae.
+

Obr. 29. Vyhodnocení testu: negativní reakce, pozitivní reakce
Důkaz ureázy
Princip:
Ureáza je hydrolytický enzym některých mikroorganismů, např. Proteus vulgaris, Klebsiella pneumonie, Citrobacter spp. Hydrolyzuje močovinu na H2O, CO2 a NH3. Zjišťuje se kultivací zkoušené kultury na šikmém agaru s močovinou a fenolovou červení nebo v tekuté půdě stejného složení.
Postup:
Zvolenou živnou půdu zaočkujeme kličkou testované kultury, inkubujeme 3 dny při 30 °C.
Hodnocení:
V případě pozitivní reakce se půda zbarví červeně případně růžově.
Důkaz indolu
Princip:
Indol vzniká z aminokyseliny tryptofanu.
Postup:
K testu se používá speciální tekutá živná půda, která se po 20 – 24 hodinách inkubace převrství 0,5 ml Ehrlichova činidla (etanolový roztok p-dimethylaminobenzaldehydu).
Hodnocení:
Je-li přítomen indol, vznikne na styčných plochách obou tekutin červený prstenec např. Escherichia coli. Negativní reakci poskytuje např. Salmonella spp. (světle žlutohnědé zbarvení).
Průkaz katalázy
Princip:
Kataláza je enzym některých aerobních a fakultativně anaerobních bakterií. Rozkládá peroxid vodíku na vodu a kyslík. Grampozitivní bakterie s pozitivní reakcí jsou např. rody Staphylococcus, Bacillus, negativní reakci dávají např. rody Streptococcus, Enterococcus, Lactobacillus, Clostridium. Většina gramnegativních bakterií je kataláza pozitivní např. čeleď Enterobacteriaceae.
Pracovní postup:
Dokazuje se těmito způsoby:
- Na čistém podložním skle se suspenduje vyšetřovaná kolonie v kapce 10% roztoku H2O2.
- Do zkumavky s 1 ml 10% roztoku H2O2 se přenese očkovací kličkou vyšetřovaná kolonie.
- K bujónové kultuře ve zkumavce se přidá asi 1 ml 10% H2O2.
Hodnocení:
Sledujeme uvolňování bublinek kyslíku a šumění. Pozitivní reakce se ve všech případech projeví uvolňováním kyslíku ve formě bublinek. Roztok H2O2 se má používat čerstvý. Živná půda, např. krevní agar, který sám dává pozitivní reakci, může ovlivnit výsledek.
Princip:
Cytochromaxidáza je enzym, který se podílí na oxidativních procesech v buňce. Důkaz je založen na oxidaci a barevné změně oxidačního činidla. Dokazuje se pomocí činidla obsahujícího dva díly 1% vodného roztoku dimethyl-p-fenylendiaminhydrochloridu a 1 díl alkoholového roztoku α-naftolu, kterým se napustí filtrační papír, za vzniku indofenolové modři. Většina gramnegativních bakterií je oxidáza pozitivní, fermentující bakterie z čeledi Enterobacteriaceae dávají negativní reakci.
Postup:
Na vlhký proužek se nanese sterilní platinovou, skleněnou nebo plastovou kličkou nebo jehlou kolonie vyšetřované kultury. Barevná reakce se odečítá do 0,5 až 1 minuty. Také je možné otisknout zónu proužku přímo na kulturu. V místě nátěru vznikne modré nebo fialové zbarvení. Zkoušku je možno provést také s tekutou kulturou starou 18 – 24 hodin. Do 5 ml kultury se přidá 0,3 ml roztoku dimethyl-p-fenylendiaminhydrochloridu a 0,2 ml roztoku α-naftolu. Směs se dobře promíchá.
Hodnocení:
V pozitivním případě dochází do jedné minuty k modrému zbarvení u oxidázového testu, nebo do dvou minut k červenofialovému zbarvení u cytochromoxidázového testu. Pozitivní reakci dává např. Pseudomonas aeruginosa, negativní reakci vykazuje např. Enterobacter sakazaki.
+

Obr. 30. OXItest
Důkaz hemolyzinů
Princip:
Hemolýza je v podstatě rozpouštění červených krvinek enzymem hemolyzinem, vylučovaným některými bakteriemi do prostředí, přičemž se rozkládá i krevní barvivo hemoglobin a dochází ke ztrátě červené barvy. Bakteriím s touto schopností říkáme hemolytické (hemolyzující). Rozdělujeme je do dvou skupin. Jedny přeměňují hemoglobin na methemoglobin, způsobují tzv. viridaci (viridující). Tuto schopnost označujeme jako α-hemolýzu, jsou tedy α-hemolyzující. Druhé rozkládají červené krevní barvivo hemoglobin úplně, říkáme, že způsobují β-hemolýzu a jsou β-hemolyzující. α-hemolyzující bakterie se projeví na krevním agaru tak, že kolem jejich kolonií vzniká zelenohnědý neprůhledný dvorec (zóna), tzv. viridace. β-hemolyzující bakterie se projevují na krevním agaru tak, že kolem jejich kolonií vzniká bezbarvý průhledný dvorec (zóna vyjasnění). Neprodukuje-li zkoušený kmen hemolyziny, okolí kolonie se nezmění.
Postup:
Na Petriho misku s krevním agarem naočkujeme frakcionovaně zkoušenou kulturu, kultivujeme při 37 °C 24 – 48 hodin.
Hodnocení:
Pozorujeme tvorbu zón kolem kolonií a podle jejich charakteristiky určíme typ hemolýzy. Jako α-hemolýza je označována částečná hemolýza a zelenohnědé zbarvení, jako β-hemolýza se označuje úplná hemolýza, čirý dvorec kolem kolonií a jako γ-hemolýza se označuje kolonie beze změny.
+
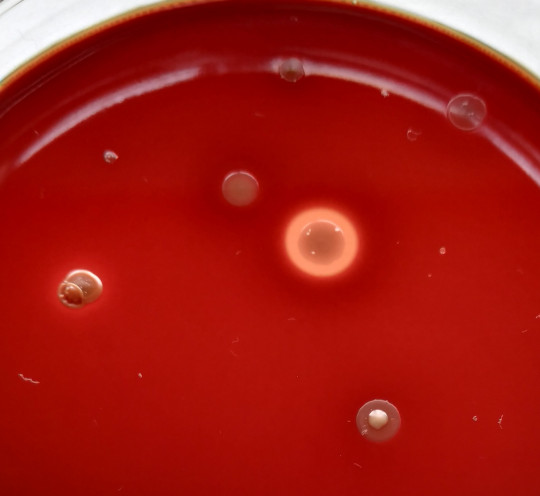
Obr. 31. β-hemolýza
+

Obr. 32. Hemolýza
Princip:
Používáme agar podle Hajny, který se využívá při zjišťování základních biochemických vlastností a předběžné identifikaci gramnegativních enterobakterií. Obsahuje tři základní cukry – glukózu, laktózu, sacharózu, železité soli, thiosíran sodný a fenolovou červeň jako indikátor štěpení cukrů. Cukry se na základě své molekulové hmotnosti v půdě rozdělí, tak že dole zůstává sacharóza, uprostřed glukóza a v horním klínu laktóza. Toto uspořádání umožňuje rozpoznat zkvašování jednotlivých cukrů. Na základě enzymatické činnosti mikroorganismů dochází ke změně barvy média, původně červená barva přechází na žlutou. Změna barvy je ovlivněna rozsahem využívaných cukrů. Současně lze sledovat tvorbu plynu a sirovodíku. Reakce sirovodíku s ionty železa se projeví tvorbou černého sulfidu železitého. TSI agar se připravuje jako šikmý agar s vyšším klínem.
Postup:
Zkumavku se šikmým agarem naočkujeme testovanou kulturou vpichem do vysokého klínu a hadovitým nátěrem na povrch šikminy. Inkubujeme při 37 °C 18 – 24 hodin. Současně očkujeme kontrolní mikroorganismus a jednu nenaočkovanou zkumavku necháme jako negativní kontrolu.
Hodnocení:
Hodnotíme změnu barvy živné půdy, tvorbu plynu (bublinky v dolní části, potrhání agaru) a tvorbu sirovodíku (černání kolem vpichu, černý prstenec na rozhraní rovné a šikmé plochy sloupce nebo zčerná celá dolní část sloupce). Pokud mikroorganismus zkvašuje pouze glukózu, zežloutne jen sloupec a šikmina zůstane červená. Pokud mikroorganismus zkvašuje současně s glukózou i laktózu nebo sacharózu, příp. všechny tři cukry, zežloutne sloupec i šikmina. Pokud původně červené médium zežloutne pouze kolem vpichu, jedná se o štěpení glukózy.
Vyhodnocení biochemické aktivity na TSI agaru
Zkvašování při očkování | Tvorba | |||
vpichem | nátěrem | plynu | H2S | |
S. typhi | + | - | - | + |
S. paratyphi B | + | - | + | + |
S. typhimurium | + | - | + | + |
Sh. flexneri | + | - | - | - |
E. coli | + | + | + | - |
Ent. aerogenes | + | + | + | - |
Proteus vulgaris | + | + | + | + |
Proteus rettgeri | + | - | - | - |
P. aeruginosa | - | - | - | - |
+

Obr. 33. Vyhodnocení testu na TSI: a) původní barva média, b) žlutý sloupec, červená šikmá plocha – kultura zkvašuje pouze glukózu, c) zežloutne celý obsah zkumavky – kultura zkvašuje současně všechny cukry, tvorba plynu se projeví tvorbou trhlinek v agaru, d) černý sloupec, červená šikmina – laktóza ani sacharóza nejsou zkvašovány, tvorba sirovodíku, e) černý sloupec, žlutá šikmina – zkvašování laktózy nebo sacharózy, tvorba sirovodíku
+

Obr. 34. Barevné změny na TSI agaru
Důkaz proteolytické činnosti
Princip:
Želatina je živočišná bílkovina, kterou proteolytické mikroorganismy svými enzymy rozkládají a ztekucují. Kasein je mléčná bílkovina. Proteolytické mikroorganismy produkují enzymy proteinázy, které katalyzují štěpení bílkovin až na aminokyseliny. Jsou to hydrolázy katalyzující hydrolýzu peptidových vazeb peptidů a bílkovin za uvolnění karboxylové a aminové skupiny.
Postup:
Zkoušený mikroorganismus zaočkujeme očkovací jehlou do vysoké vrstvy masopeptonové želatiny v mikrobiologické zkumavce tzv. vpichem. Očkovací jehlu s odebranou mikrobiální kulturou vedeme ve svislé poloze do pevné půdy asi 0,5 cm nad dno zkumavky. Po zaočkování necháme inkubovat 3 – 5 dní při teplotě 20 °C ve svislé poloze ve stojánku na zkumavky. Potom pozorujeme, zda v místě vpichu nastalo ztekucení želatiny.
K důkazu rozkladu kaseinu naočkujeme zkoušené kultury na agarovou půdu s odstředěným mlékem v Petriho misce. Inkubujeme v termostatu 3 dny při teplotě 30 °C.
Hodnocení:
Ztekucení želatiny se může projevit různým tvarem podél vpichu: miskovitým, nálevkovitým, pytlovitým, vodorovným, vrstevnatým nebo může nastat až úplné ztekucení.
Proteolytické bakterie hydrolyzují přítomný kasein a vytvářejí v okolí svých kolonií různě široký dvorec úplného vyjasnění půdy.
+
Obr. 35. Ztekucení želatiny proteolytickými bakteriemi: a) ztekucení miskovité, b) nálevkovité, c) pytlovité, d) vodorovné, e) vrstevnaté, f) úplné
+
Obr. 36. Zóna projasnění na MPA s kaseinem
Důkaz lipolytické činnosti
Princip:
Lipolytické mikroorganismy se vyznačují tím, že svými enzymy lipázami štěpí tuky (lipidy) na alkohol a mastné kyseliny. Ke stanovení lipolytických mikroorganismů můžeme použít TBA (tributyrin agar) nebo agarovou půdu s emulgovaným tukem a síranem nilské modři. Na této půdě (Goldmanova-Raymanova půda) tvoří lipolytické bakterie kolem svých kolonií světle zelený až modrý dvorec (zónu), podle intenzity štěpení tuku.
Postup:
Na Petriho misky s TBA naočkujeme lehkým dotekem očkovací kličkou testovaný mikroorganismus. Kultivujeme při 30 °C 24 – 72 hodin.
Hodnocení:
V místech, kde rostou lipolytické mikroorganismy a dochází ke štěpení tuku, se živná půda vyjasní a vytvoří se zóna projasnění.
+
Obr. 37. Zóna projasnění na TBA
+

Obr. 38. Lipolytická činnost mikroorganismů
2.1.4.2
Využití diagnostických testů
Při rutinním určování velkého počtu izolátů se v mikrobiologických laboratořích používají miniaturizované metody, které vyšetření podstatně zjednodušují, urychlují a zlevňují. Byly vyvinuty standardizované diagnostické soupravy tzv. mikrotesty, které obsahují více testů (10 – 24) v jedné soupravě, jsou jednoduché, snadno se provádějí, vyhodnocení se provádí pomocí diagnostických tabulek. Na rozdíl od zkumavkových metod mají dostatečně dlouhou dobu expirace. Jedná se o plastové mikrodestičky, v jamkách jsou dehydratovaná diagnostická média. Očkuje se 0,1 ml suspenze o předepsané hustotě připravené z čisté kultury. Při přípravě se využívá McFarlandova zákalová stupnice. Další kroky jako převrstvení parafínovým olejem a přídavek činidla po inkubaci se provádějí podle pokynů přiložených k testu. Hodnocení výsledků po 18 – 24 hodinové inkubaci se provádí podle originální tabulky nebo lze využít počítačový program TNW (mikrobiologický identifikační systém).
Každá souprava obsahuje návod k použití, barevné tabulky pro vyhodnocení výsledků, tabulky pro zapisování výsledků, parafínový olej, reagencie, neprůhledné sáčky na kultivaci.
Některé příklady diagnostických souprav:
ENTEROtest (16,24) a ENTERO Rapid – identifikace gramnegativních fermentujících tyčinek (z čeledi Enterobacteriaceae)
ANAEROtest – identifikace anaerobů
STAPHYtest – identifikace stafylokoků a grampozitivních kataláza pozitivních koků
STREPTOtest – rozlišení streptokoků a enterokoků
NEFERMtest – identifikace gramnegativních nefermentujících tyčinek
+

Obr. 39. Enterotest
+
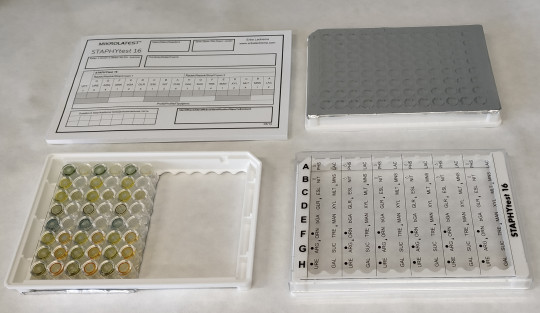
Obr. 40. Staphytest
Příklad
Úkol: Nácvik identifikace bakterií.
Mikroorganismy: Escherichia coli, Bacillus subtilit, Serratia marcescens, Pseudomonas fluorescens, Staphylococcus aureus, Micrococcus luteus
Pomůcky: sterilní Petriho misky, příslušné polotuhé živné půdy, příslušné tekuté živné půdy, kultury testovaných mikroorganismů, sterilní hokejky, očkovací jehla, očkovací klička, pomůcky na barvení
Postup:
- Připravte si aseptické prostředí a pomůcky, které budete potřebovat.
- U testovaných kultur proveďte diagnostické barvení podle Grama.
- Podle postupu zaočkujte vybrané testy.
- Jednotlivé testy kultivujte při optimální teplotě a době.
- Po kultivaci testy vyhodnoťte a výsledky zapište do tabulky.
Hodnocení:
Získané výsledky zapište do tabulky a podle identifikačního klíče ověřte, zda se výsledky shodují s použitou známou kulturou.
Závěr:
Zhodnoťte výsledky a úspěšnost stanovení. Porovnejte výsledky v rámci celé skupiny.
2.1.5
Kontrolní test
Co je čistá kultura?
Které mikroskopické vyšetření je vhodné provádět při identifikaci bakterií?
Jakým způsobem se projevuje růst v tekutém médiu.
Jakým způsobem můžeme stanovovat pohyblivost mikroorganismů?
Amylolytické mikroorganismy?
Kterým činidlem dokážeme produkty rozkladu škrobu?
Který test slouží k důkazu tvorby acetoinu?
Co je kataláza?
Co je to hemolýza?
Jaké máme druhy hemolýzy?
Jak se zjišťuje proteolytická činnost mikroorganismů?
Které enzymy produkují mikroorganismy při rozkladu bílkovin?
Co jsou to mikrotesty?
Podle čeho určujeme intenzitu zákalu suspenze kultury?
Při jakých podmínkách nejčastěji kultivujeme bakterie?