1.5
Vliv chemických faktorů
Chemické složení prostředí je jedním z hlavních činitelů, ovlivňujících růst a množení mikroorganismů. Chemické látky můžou mít na mikroorganismy příznivý i nepříznivý vliv. Řada chemických látek působí na mikroorganismy inhibičně až toxicky. Jsou to látky antimikrobiální, které můžeme využívat jako konzervační prostředky, dezinfekční prostředky, léky apod.
Rozeznáváme účinek mikrobistatický, kdy dochází k zastavení růstu a rozmnožování, mikrobicidní, při kterém působí látky na buňky letálně. Negativní působení se projeví snížením počtu buněk, zastavením jejich rozmnožování nebo odumřením. Často o účinku rozhodují i jiné faktory jako např. doba a teplota působení, koncentrace látky, fyziologický stav mikroorganismů.
Příklad
Úkol: Bakteriostatické působení barviv.
Princip: V mikrobiologické praxi využíváme často bakteriostatického účinku některých barviv. Vhodné barvivo inhibuje (potlačuje) růst určitých skupin mikroorganismů, čehož využíváme při přípravě některých selektivních půd, užívaných např. při stanovení koliformních bakterií. Nejčastěji se přidává krystalová nebo genciánová violeť, malachitová zeleň, methylenová modř.
Mikroorganismy: Escherichia coli, Serratia marcescens, Bacillus subtilis, Micrococcus luteus
Pomůcky: 1% vodný roztok krystalové violeti, sterilní zkumavky, sterilní Petriho misky, sterilní destilovaná voda, pipety, MPA
Postup:
- Připravte si aseptické prostředí a pomůcky, které budete potřebovat.
- Zásobní roztok krystalové violeti nařeďte asepticky 10×, 100× a 1 000×.
- Do 4 Petriho misek sterilně napipetujte příslušné ředění barviva.
- Do první Petriho misky napipetujte 1 ml neředěného barviva, do druhé Petriho misky 1 ml 10× ředěného barviva, do třetí 1 ml 100× ředěného barviva a do poslední 1 ml 1 000× ředěného barviva.
- Asepticky nalijte do Petriho misek rozvařenou živnou půdu (15 – 20 ml) a opatrně, ale důkladně promíchejte živnou půdu s barvivem a nechejte utuhnout.
- Po ztuhnutí rozdělte dno misek lihovým fixem na čtvrtiny a na každou z nich naočkujte čárkováním (hadem) uvedené druhy bakterií.
- Jako kontrolu obdobně naočkujte pátou Petriho misku s čistou živnou půdou.
- Inkubujte 24 hodin při 37 °C.
- Po inkubaci misky vyhodnoťte a zpracujte protokol.
Hodnocení:
Podle intenzity růstu bakterií vyhodnoťte působení barviva. Výsledky zaznamenejte do tabulky, porovnejte růst gramnegativních bakterií s růstem bakterií grampozitivních.
Závěr:
Zhodnoťte bakteriostatické působení barviv na růst mikroorganismů. Porovnejte výsledky v rámci celé skupiny.
1.5.1
Vliv antibiotik
V roce 1928 Alexander Fleming objevil antibiotické působení plísně Penicillium chrysogenum, ale až v roce 1939 vědci Howard Walter Florey a Ernst Boris Chain dokázali izolovat penicilin. Od té doby jsou antibiotika a chemoterapeutika látkami používajícími se při léčbě onemocnění mikrobiálního původu. Vlivem neuváženého a častého používání antibiotik narůstá výskyt rezistentních kmenů bakterií. Proto je nezbytné izolovat a určit patogenní mikroorganismus a otestovat jeho citlivost na vhodné antibiotikum a pak zvolit racionální a cílenou léčbu.
K testování citlivosti se používají kvalitativní a kvantitativní metody.
Kvalitativní metody slouží k rychlé orientaci. Používá se difúzní disková metoda, kdy na povrch živné půdy MHA (Müller-Hintonův agar) v Petriho misce se naočkuje rovnoměrně roztěrem testovaný mikroorganismus. Papírové disky napuštěné známými koncentracemi antibiotik se položí a lehce přitisknou na povrch agaru. V průběhu inkubace antibiotika prostupují z disku do půdy. Účinné antibiotikum vytvoří kolem disku průzračnou zónu bez nárůstu buněk. Vyhodnocení se provádí měřením průměrů zóny v mm.
Kvantitativními metodami určujeme buď minimální množství antibiotika v mikrogramech na mililitr MIC (minimální inhibiční koncentrace), které je potřebné k zastavení růstu daného mikroorganismu. Nebo určujeme baktericidní účinek antibiotika, který stanovujeme jako minimální baktericidní koncentraci MBC (minimální baktericidní koncentrace). Stanovení se provádí plotnovou nebo zkumavkovou ředící metodou.
+

Obr. 6. Disky s antibiotiky
+

Obr. 7. Petriho miska s disky a zóny projasnění
+
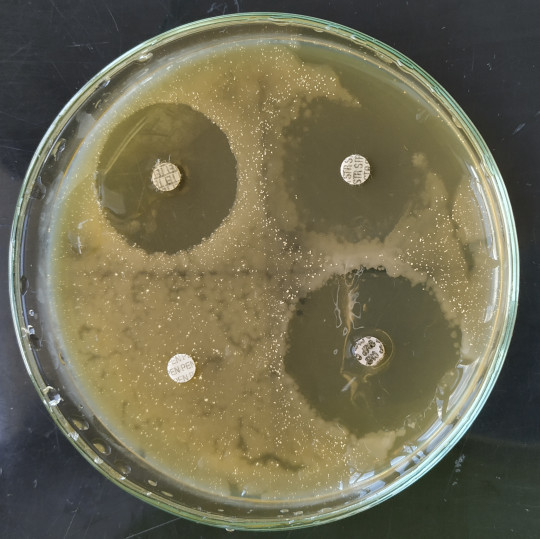
Obr. 8. Vyhodnocení vlivu antibiotik
Příklad
Úkol: Zjištění citlivosti mikroorganismů k antibiotikům.
Mikroorganismy: Escherichia coli, Bacillus subtilit, Serratia marcescens, Staphylococcus aureus, Pseudomonas fluorescens, Micrococcus luteus
Pomůcky: sterilní Petriho misky, MPA, MHA, kultury testovaných mikroorganismů, testovací disky s antibiotiky, sterilní hokejky, pinzety, pipety, fyziologický roztok, zákalová stupnice
Postup:
- Připravte si aseptické prostředí a pomůcky, které budete potřebovat.
- Do 5 ml fyziologického roztoku suspendujte 24 hodin starou kulturu, vytvořte suspenzi 2. stupně McFarlandovi zákalové stupnice.
- Zaočkujte roztěrem 0,1 ml testovaného mikroorganismu, vždy na obě použité živné půdy. Inokulované Petriho misky nechte zaschnout.
- Sterilní pinzetou položte na povrch půdy rovnoměrně testovací disky s antibiotiky tak, aby byly dostatečně vzdáleny od kraje misky i od sebe navzájem. Na jednu Petriho misku použijte 4 disky. Disk lehce na povrch přitiskněte tak, aby po obrácení misky dnem vzhůru nespadl.
- Kultivujte 24 hodin při teplotě 37 °C.
Hodnocení:
Sledujte tvorbu zón (projasnění) kolem disků, změřte jejich velikost a výsledky zaznamenávejte do tabulky. Velikost zóny 5 – 10 mm odpovídá citlivému mikroorganismu, velikost zóny 12 mm a více velmi citlivému mikroorganismu. Výsledky slovně komentujte.
Závěr:
Zhodnoťte citlivost mikroorganismů vůči různým antibiotikům. Porovnejte výsledky v rámci celé skupiny.
1.5.2
Vliv antimikrobních látek z rostlin
Některé rostliny obsahují specifické látky, které potlačují růst a množení mikroorganismů. K tomu dochází různými mechanismy, např. poškozením enzymatického systému metabolických drah, poškozením struktury a funkce buněčné stěny apod. Tyto účinné látky jsou obsaženy často v koření, aromatických rostlinách, v levanduli, tymiánu, mateřídoušce, meduňce, pažitce, česneku, cibuli, ale také v ananasu nebo čaji. Jejich účinnost je možné stanovit například diskovou difúzní metodou.
+

Obr. 9. Sterilní disky filtračního papíru
Příklad
Úkol: Antimikrobiální aktivita účinných látek z rostlin.
Mikroorganizmy: Escherichia coli, Bacillus subtilit, Serratia marcescens, Pseudomonas fluorescens, Staphylococcus aureus, Micrococcus luteus
Pomůcky: sterilní Petriho misky, MPA, kultury testovaných mikroorganismů, sterilní disky, sterilní hokejky, pinzety, výluhy rostlin, zákalová stupnice
Postup:
- Připravte si aseptické prostředí a pomůcky, které budete potřebovat.
- Do 5 ml fyziologického roztoku suspendujte 24 hodin starou kulturu, vytvořte suspenzi 1. stupně McFarlandovi zákalové stupnice.
- Na Petriho misku s živnou půdou naočkujte roztěrem 0,1 ml testované kultury.
- Sterilní disky z filtračního papíru (o průměru 9 mm) namočte do zkoumaného roztoku.
- Pinzetou přeneste vždy tři napuštěné disky na naočkovanou Petriho misku. Provádí se dvě opakování, tzn. dvě Petriho misky pro jednu účinnou látku a mikroba.
- Disky jemně přitiskněte, aby nedošlo k jejich odlepení při kultivaci.
- Inkubujte 24 hodin při teplotě 37 °C.
Hodnocení:
Po kultivaci vyhodnoťte tvorbu inhibičních zón a změřte jejich průměr (tedy včetně disku). Do tabulky zaznamenejte šest hodnot a jejich aritmetický průměr. Následně porovnejte účinnost jednotlivých látek, či citlivost jednotlivých testovaných mikroorganismů.
Závěr:
Zhodnoťte antimikrobiální aktivitu účinných látek z rostlin. Porovnejte výsledky v rámci celé skupiny.
1.5.3
Vliv konzervačních prostředků
Konzervace je ochrana surovin a potravin před nežádoucími rozkladnými procesy mikroorganismů, umožňuje přeměnit surovinu na formu skladovatelnou. Podle toho, kterých činitelů vnějšího prostředí používáme k potlačení mikrobiální činnosti, rozdělujeme způsoby potravin a konzervace do několika hlavních skupin.
- Vylučování mikroorganismů z prostředí.
- Usmrcování mikroorganismů.
- Úprava prostředí.
- Biologické zásahy.
- Kombinace konzervačních metod.
Příklad
Úkol: Stanovení citlivosti mikroorganismů k vybraným konzervačním látkám.
Mikroorganismy: Escherichia coli, Bacillus subtilis, Micrococcus luteus, Pseudomonas fluorescens, Serratia marcescens
Pomůcky: sterilní Petriho misky, špičky, korkovrt, sterilní voda, zkumavky, pipety, roztoky konzervačních látek, fyziologický roztok, MPA, zákalová stupnice
Postup:
- Připravte si aseptické prostředí a pomůcky, které budete potřebovat.
- Do 5 ml fyziologického roztoku suspendujte 24 hodin starou kulturu, vytvořte suspenzi 1. stupně McFarlandovi zákalové stupnice.
- Připravte si sterilní roztoky konzervačních látek ve sterilní destilované vodě v těchto koncentracích: benzoan sodný: 0,5; 1,0; 1,5; 10,0%, kyselina mravenčí: 4,0; 6,0; 8,0; 10,0% a kyselina sorbová: 0,25; 0,50; 0,75; 1,00%.
- Do sterilní Petriho misky napipetujte 1 ml kultury mikroorganismů a zaočkujte přelivem.
- Po utuhnutí živné půdy sterilním korkovrtem vyřízněte v každé misce rovnoměrně 5 otvorů, které na dně misky očíslujte lihovým fixem.
- Do každého otvoru asepticky pipetujte postupně 0,1 ml zředěných konzervačních činidel.
- Do pátého otvoru napipetujte jako kontrolu 0,1 ml sterilní destilované vody, která byla použita k ředění konzervačních činidel.
- Inkubujte 24 hodin při 37 °C.
Hodnocení:
Po kultivaci vyhodnoťte tvorbu inhibičních zón a změřte jejich průměr. Do tabulky zaznamenejte hodnoty a porovnejte účinnost jednotlivých látek, či citlivost jednotlivých testovaných mikroorganismů.
Závěr:
Zhodnoťte citlivost mikroorganismů vůči použitým konzervačním látkám. Porovnejte výsledky v rámci celé skupiny.