1.2
Nepřímé metody
1.2.1
Kultivační metody
Ve většině laboratoří se používá klasická plotnová metoda. Její automatizovaná podoba je pomocí přístroje Mini-Petrifoss. K rozborům slouží sterilní plastikové Petriho misky na jedno použití. Přístroj je samočinně dopraví ze zásobníku, otevře, odebere vzorek mikrokličkou, spláchne jej do Petriho misky, přidá odměřené množství živné půdy, uzavře víčkem, promíchá obsah, označí misku a uloží ji do zásobníku naočkovaných misek. Po inkubaci v termostatu se kolonie automaticky odečítají na počítačích. V našich laboratořích se dnes již tato automatizovaná metoda nepoužívá, byla nahrazena jinými.
1.2.1.1
Metody standardní kultivační
CPM – 105 KTJ/ml
Vyhodnocuje se jako klouzavý geometrický průměr za poslední dva měsíce nejméně ze dvou rozborů měsíčně.
Celkový počet mikroorganismů (CPM) představují mezofilní aerobní a fakultativně anaerobní mikroorganizmy tvořící kolonie na neselektivních, nutričně bohatých půdách při teplotě 30 °C během 72 hodin. Živná půda je agar s glukózou, tryptonem a kvasničným extraktem (GTK), inokulace vzorku přelivem 1 ml, inkubace 30 °C, doba 72 hodin, aerobně.
Termorezistentní – 2·103 KTJ/ml (inaktivace)
Termorezistentní mikroorganizmy se vyznačují odolností vůči záhřevu. Před inokulací je třeba inaktivovat ostatní mikroorganizmy pasterací mléka (85 °C 5 minut). Živná půda je agar s glukózou, tryptonem a kvasničným extraktem (GTK), inokulace vzorku přelivem 1 ml, inkubace 30 °C, doba 72 hodin, aerobně.
Psychrotrofní – 5·104 KTJ/ml kultivace 6,5 °C 10 dnů, mikrokolonie
Psychrotrofní mikroorganizmy tvoří počitatelné kolonie při teplotě 6,5 °C za 10 dnů. Živná půda je agar s glukózou, tryptonem a kvasničným extraktem PCA (GTK), inokulace vzorku roztěrem 0,1 ml na předsušenou živnou půdu, inkubace 6,5 °C 10 dnů, aerobně.
Koliformní – 103 KTJ/ml
Koliformní bakterie jsou považovány za indikátory fekálního znečištění a poukazují na nevhodné hygienické podmínky v zemědělském či potravinářském provozu. Živná půda je VČŽL – Agar s krystalovou violetí, neutrální červení, žlučovými solemi a laktózou. Vzhled kolonií – jasně růžové, někdy se světlým okrajem, precipitátem pod koloniemi v podobě růžových skvrn nebo úzké zóny kolem kolonií, velikosti 1 – 3 mm. Inokulace vzorku přelivem, inkubace 30 °C, doba 48 hodin, aerobně.
Anaerobní spory – negat. v 0,1 ml
Používá se stanovení Weinzirlovým testem. Testované mléko se očkuje do sterilního mléka nebo želatinového agaru, přelije parafinem. Provede se inaktivace při 85 °C 5 min a inkubuje při 37 °C 5 dnů. Hodnotí se vzhled sraženiny a přítomnost plynu.
+

Obr. 1. Weinzirlův test – kontrola živné půdy
+
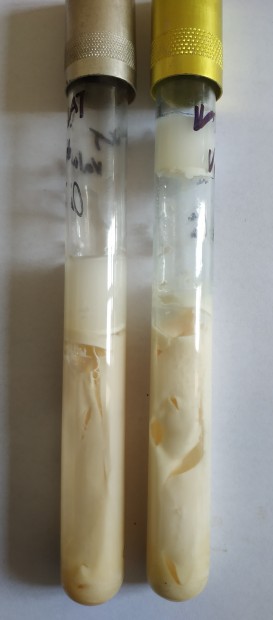
Obr. 2. Weinzirlův test – pozitivní nárůst, tvorba plynu
1.2.1.2
Mikrometody
Rychlé, spolehlivé, miniaturizované metody pro identifikaci bakterií. V jamkách mikrotitrační destičky jsou umístěna vysušená diagnostická media (1 jamka = 1 test), jedna destička obsahuje 8 – 24 sérií těchto jamek (může se tedy identifikovat 8 – 24 kmenů). Přidáním 0,1 ml suspenze bakterií do jamek se médium rozpustí a po 6 – 24 hod kultivace při 30 – 37 °C se vizuálně zaznamenají změny reakcí. Vyhodnocení probíhá pomocí počítačového programu, u netypických reakcí se udělají doplňkové testy.
Enterotest 16, 24, Entero-Rapid test, Nefermtest, Staphytest, Streptotest, Anaerotest, …
+

Obr. 3. Enterotest
+
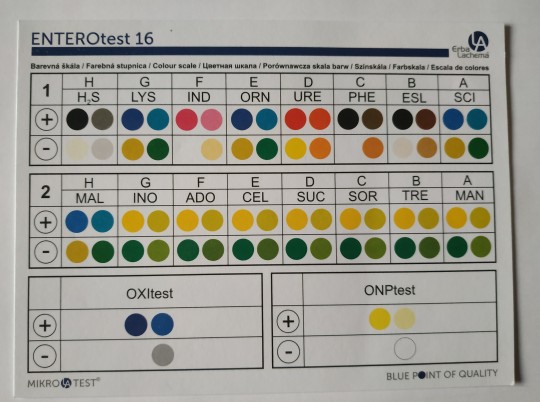
Obr. 4. Vyhodnocení Enterotestu 16
1.2.2
Enzymové metody
Jsou založeny na zjištění změn, které mikroflóra přítomná ve vzorku zkoušeného mléka způsobí svými enzymy. Rozsah změn je úměrný počtu mikroorganizmů. Nejčastěji slouží k odhadu počtu mikroorganizmů změna kyselosti mléka, redoxního potenciálu, vodivost a produkce důležitých meziproduktů látkové výměny. Po technické stránce lze tyto metody rozdělit na jednoduché zkumavkové zkoušky a technicky i velmi náročné přístrojové metody, které bývají automatizovány.
1.2.2.1
Zkumavkové metody
- Zkoušky kyselosti
Změny kyselosti byly sledovány podle rychlosti a charakteru srážení, podle dosažené hodnoty pH po inkubaci nebo podle rozdílu titrační kyselosti na počátku a na konci kultivace. Tyto zkoušky patřily k prvním kontrolním metodám, ze kterých se postupně vyvíjela dnešní, mnohdy velmi složitá kontrola.
- Kvasná zkouška
Zkouška je založena na skutečnosti, že mikroorganizmy přítomné ve mléce vyvolávají během inkubace vzorku změny v konzistenci. Podle povahy sraženiny lze usuzovat na převládající typ mikroorganizmů. Z rychlosti srážení je možné odhadnout počet buněk.
Provedení kvasné zkoušky: Zkumavky se zkoušenými vzorky mléka se inkubují 24 hodin při 37 °C. Potom se posuzuje vzniklá sraženina.
Tabulka 1. Vyhodnocení kultivací
Jakostní třída | Sraženina | Mikroflóra |
I. | Sraženina je celistvá, porcelánovitá, obsahuje nejvýš 1 až 2 plynové bublinky nebo jejich souvislé stopy. | V mléce jsou přítomny převážně baktérie mléčného kvašení. |
II. | Sraženina je prostoupena bublinkami, trhlinkami, může vyvstávat syrovátka nebo vrstva peptonizovaného mléka do hloubky asi 1 cm. | Mléko je více kontaminováno plynotvornými (koliformními), popř. i peptonizačními mikroorganizmy. |
III. | Sraženina je klkovitá, mléko bývá silně peptonizováno, může docházet ke značné tvorbě plynů. | Mléko je silně kontaminováno plynotvornými a peptonizačními baktériemi, popř. baktériemi máselného kvašení. |
Mléko, které se do 24 hodin vůbec nesrazilo. | Přítomnost inhibičních látek, bakteriofágů, změny v chemickém složení mléka a v zastoupení kyselinotvorné mikroflóry v mléce v důsledku onemocnění dojnic apod. !!! mléko se nesmí zpracovávat!!! |
Kvasná zkouška se doporučuje jako součást hodnocení mléka vedle zkoušky resazurinové (popř. reduktázové). Umožňuje zjistit, zda případný dobrý výsledek redukční zkoušky nebyl způsoben inhibicí mikroorganizmů přídavkem dezinfekčního činidla.
- Oxidoredukční metody
Největší rozšíření v praxi doznaly redukční metody založené na změně redoxního potenciálu zjištěné pomocí indikátoru resazurinu nebo methylenové modři. Tyto zkoušky se používaly po celém světě a pro potřebu stanovení jakostních tříd a proplácení mléka začaly být nahrazovány přístrojovými automatizovanými metodami.
Redukční zkoušky nepostihují podstatnou část psychrotrofní mikroflóry, která může mít rozhodující vliv na kvalitu mléka. Psychrotrofní mikroflóra za podmínek redukčních testů nezpůsobuje redukci indikátorů a není vlastně zaregistrována. Na druhé straně mezofilní mikroflóra je hlubokým zchlazením dočasně fyziologicky oslabena a neprojevuje se dostatečně aktivně. Klamné výsledky byly dosahovány také ve vzorcích obsahujících inhibiční látky. Pouze přibližná hodnota výsledků má význam pouze orientační.
- Resazurinová zkouška
Většina mikroorganizmů kontaminujících syrové mléko produkuje enzymy redukující modrý resazurin přes červený resorufin na bezbarvý dihydroresorufin. Zbarvení mléka s indikátorem se mění z modré na červenou, případně dojde k úplnému odbarvení. Čím více je ve vzorku mikroorganizmů, tím k výraznějšímu zbarvení dojde za určenou dobu.
Provedení: Do 10 ml mléka vytemperovaného na 37 °C se přidá 1 ml indikátoru (0,01% roztok resazurinu) a po promíchání se inkubuje při 37 °C. Po 120 minutách se určí zbarvení.
Tabulka 2. Hodnocení resazurinové zkoušky
Jakostní třída | Změny mléka |
I. | mléko zůstalo modré (obsahuje málo mikroorganizmů) |
II. | mléko fialové, červenofialové až červené |
III. | mléko růžové až odbarvené |
Pozn.: Indikátor se používá čerstvý, nejdéle do 24 hodin po přípravě, je-li uložen v chladu a temnu.
+

Obr. 5. Vyhodnocení resazurinové zkoušky
- Reduktázová zkouška (již se neprovádí)
Mikroflóra mléka je schopna redukovat přidaný indikátor methylenovou modř na její leukoformu (bezbarvou formu původně modré sloučeniny). Stanovuje se rychlost, s jakou dojde k odbarvení vzorku. Čím dříve je vzorek odbarven, tím více obsahuje mikroorganizmů.
Provedení: Do 20 ml mléka vytemperovaného na 37 °C se přidá 0,5 ml indikátoru methylenové modři a promíchá se. Inkubuje se při 37 °C a zjišťuje se rychlost odbarvení po 20, 60, 120 a 240 minutách. Hodnotí se podle tabulky. Po odečtení se mohou zkumavky ponechat v termostatu nebo vodní lázni do druhého dne. Po 24 hodinách se podle povahy sraženiny posuzuje charakter mikroflóry mléka – viz kvasná zkouška.
Tabulka 3. Hodnocení reduktázové zkoušky
Jakostní třída | Doba potřebná k redukci (odbarvení) |
I. | více než 4 hodiny |
II. | 1 až 4 hodiny |
III. | do 1 hodiny |
1.2.3
Přístrojové metody
- Stanovení pyruvátu
Pyruvát (CH3COCOO-) je klíčovým meziproduktem látkové výměny a jeho obsah záleží na aktivitě a množství přítomných mikroorganizmů. Stanovuje se převedením pyruvátu na laktát. Reakce se dá citlivě měřit fluorometricky a celý proces se dá automatizovat. Obsah ve mléce se dá stanovovat kontinuálně.
- ATP – test
Adenosintrifosfát (ATP) je sloučenina uskutečňující při látkové výměně přenos energie. Jeho obsah, který je úměrný množství aktivních bakterií se dá stanovit enzymatickou luminiscenční metodou (transformace chemické energie na světelnou). Počet mikroorganismů se dá tímto způsobem zjistit v rozmezí 10 až 45 minut. K indikaci ATP se používá měření luminiscence přidaného komplexu luciferin – luciferáza.
Luciferin
světélkující metabolit (excitovaný stav → vyzařuje světelná kvanta)
Luciferin je sloučenina, která přechází do excitovaného (vzbuzeného) stavu vlivem ATP a luciferázy. Luciferáza je enzym katalyzující transformaci energií. K měření intenzity luminiscence se používají přístroje – luminometry. Měří počet relativních světelných jednotek (RLU), který odpovídá počtu mikroorganizmů. Např. přístroj dánské firmy Foss Elektric BACTOFOSS.
- Metoda průtokové cytometrie
Vzorek mléka obarvený fluorescinem je vstřikován do laminárně proudícího media, proud unášející jednotlivé buňky je ozářen paprskem monochromatického světla, záblesky emitované fluorescence se fotobuňkou mění na elektrické impulsy, po automatickém přepočtu viditelné na displeji.
- Stanovení počtu bakterií podle změn impedance
V živném prostředí se v důsledku enzymové činnosti bakterií mění elektricky inertní molekuly substrátu v ionizované sloučeniny (např. cukry v organické kyseliny). Tím se zmenšuje odpor, který klade prostředí průchodu elektrického proudu. Změny lze stanovit pomocí elektrod. Rychlé nahromadění ionizovaných sloučenin v mediu souvisí s počtem mikrobů. Na tomto principu byly sestrojeny měřicí přístroje, které umožňují automaticky proměřovat impedanci (celkový odpor prostředí) velkého množství vzorků současně. Sleduje se čas potřebný k tomu, aby počáteční inokulum dosáhlo prahové hodnoty (detekční čas impedance) a impedanční profil – průběh změn impedance v závislosti na čase během růstu kultury a celkový rozsah změny vodivosti. Je možné použití různých živných půd a různých kultivačních teplot.
Využití – přístroj BacTrac.
Příklad
Úkol:
Proveďte rozbor syrového mléka
- stanovení CPM
- stanovení koliformních mikroorganizmů
- stanovení termorezistentních a sporotvorných aerobních mikroorganizmů
- stanovení sporotvorných anaerobů
- resazurinová zkouška
- kvasná zkouška
Postup práce:
- stanovení CPM
Vypočítejte hlavní a vedlejší ředění
Nakreslete schéma očkování
Připravte si všechny pomůcky podle schématu
Proveďte homogenizaci vzorku
Připravte vypočítaná ředění a naočkujte na misky inokulum 1 ml
Proveďte dosoušení živné půdy 55 °C 30 minut
Misky zabalte a dejte kultivovat dnem vzhůru 30 °C, 72 h
Výsledky vyhodnoťte
- stanovení koliformních MO
Vypočítejte hlavní a vedlejší ředění
Nakreslete schéma očkování
Připravte si všechny pomůcky podle schématu
Proveďte homogenizaci vzorku
Připravte vypočítaná ředění a naočkujte na misky inokulum
Misky zabalte a dejte kultivovat dnem vzhůru 30 °C, 24 – 48 h
Výsledky vyhodnoťte
- stanovení termorezistentních a sporotvorných aerobních MO
Proveďte inaktivaci vzorku (10 ml) 85 °C, 5 min
Vypočítejte hlavní a vedlejší ředění. Na očkování použijete jiné ředění než u stanovení CPM!
Nakreslete schéma očkování
Připravte si všechny pomůcky podle schématu
Proveďte homogenizaci vzorku
Připravte vypočítaná ředění a naočkujte na misky inokulum
Proveďte dosoušení živné půdy 55 °C 30 minut
Misky zabalte a dejte kultivovat dnem vzhůru 30 °C, 72 h
Výsledky vyhodnoťte
- stanovení sporotvorných anaerobů upraveným Weinzirlovým testem
Do sterilního mléka ve zkumavce napipetujte vzorek
Převrstvěte 5 – 10 mm vysokou vrstvou sterilní parafin-vazelinové směsi
Inaktivujte ve vodní lázni při 85 °C 5 minut
Pak vychlaďte na 37 °C a při této teplotě inkubujte 5 dnů
Jsou-li sporuláty přítomny, způsobí koagulaci, peptonizaci nebo tvorbu plynu případně kombinaci uvedených projevů
Počet spor stanovte technikou MPN
- resazurinová zkouška
Do 10 ml mléka vytemperovaného na 37 °C přidejte 1 ml indikátoru (0,01% roztok resazurinu)
Po promíchání inkubujte při 37 °C
Po 120 minutách určete zbarvení
Vyhodnoťte podle schématu
- kvasná zkouška
Zkumavky se zkoušenými vzorky mléka inkubujte 24 hodin při 37 °C
Vyhodnocení proveďte podle schématu
Byl do vzorku přidán dezinfekční roztok?